Les fragments d’anticorps inhalables offrent une large protection contre les variants du SRAS-CoV-2
Les anticorps neutralisants sont largement utilisés pour traiter la maladie à coronavirus 2019 (COVID-19) causée par le syndrome respiratoire aigu sévère viral 2 (SRAS-CoV-2). Cependant, cette approche thérapeutique est associée à plusieurs limitations, notamment l’incapacité à stériliser la muqueuse du site de précipitation virale, l’émergence de variants résistants aux anticorps et des coûts élevés.
Nouveau Thérapie moléculaire L’étude décrit une nouvelle approche potentielle pour traiter le COVID-19 sous la forme de petits anticorps humains qui peuvent être utilisés comme des nanocorps mais à un niveau de risque inférieur.
Stady : Les fragments d’anticorps humains inhalables neutralisent les variants du SRAS-CoV-2 pour le traitement du COVID-19. Crédit d’image : Huen Structure Bio / Shutterstock.com
introduction
Initialement, les nanocorps à domaine unique basés sur la région variable de l’anticorps à chaîne lourde anti-SARS-CoV-2 ont été considérés comme une méthode thérapeutique potentielle pour une utilisation par inhalation par rapport aux anticorps monoclonaux systémiques. Ces nanocorps sont d’origine cameline et doivent donc être humanisés par des procédés potentiellement coûteux et réducteurs de portée.
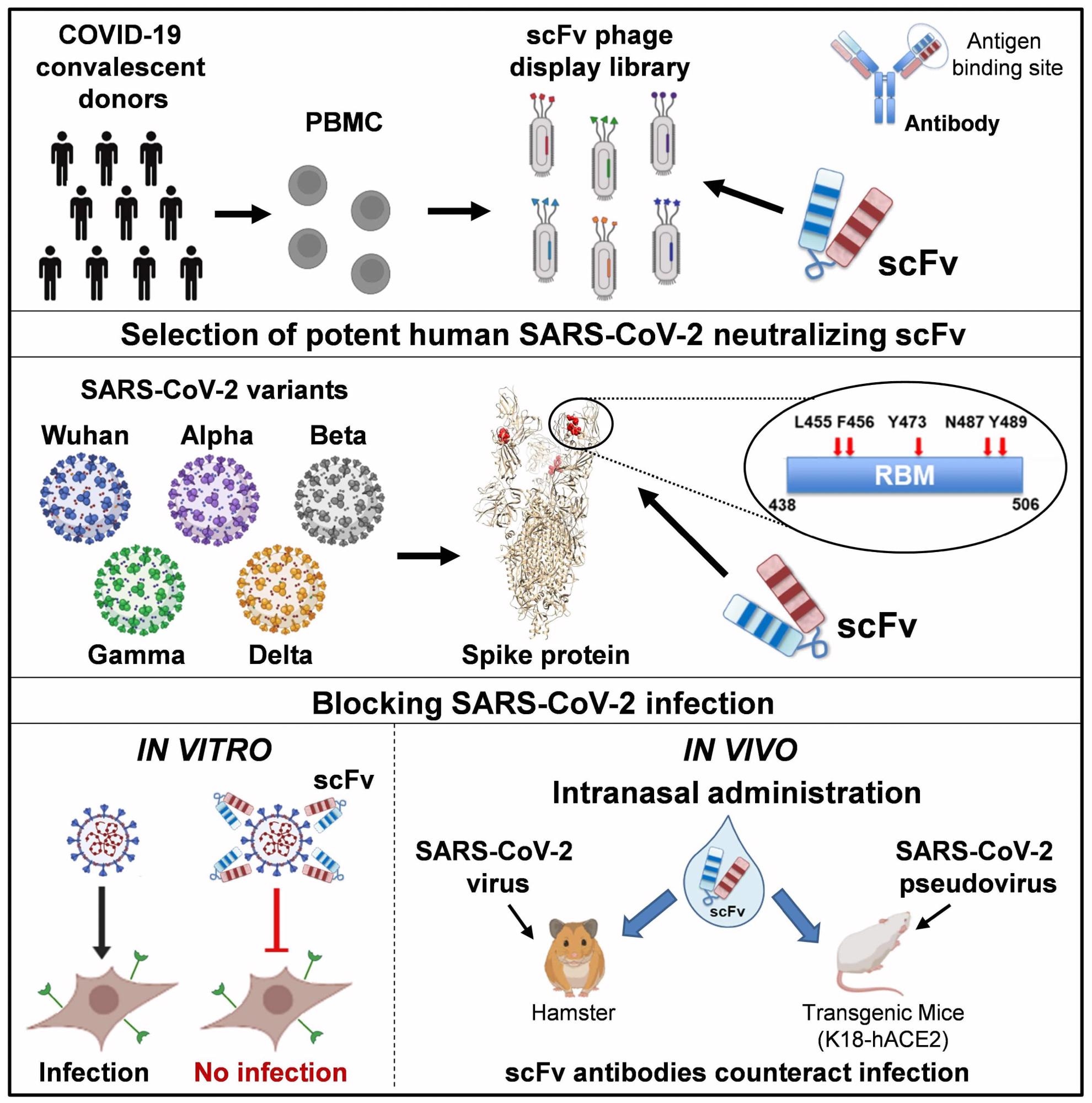
L’étude actuelle se concentre sur les petits anticorps humains générés par l’ingénierie de l’immunoglobuline (Ig) variante légère et le séquençage lourd ensemble, formant un seul petit polypeptide polypeptidique grâce à l’utilisation d’un lieur peptidique flexible. Le ligand permet aux domaines fonctionnels de liaison à l’antigène d’être reconstitués en anticorps à fragment unique variable (scFv).
Notamment, les anticorps scFv ne contiennent pas la partie cristallisable (Fc) de la molécule d’anticorps et, par conséquent, ne provoquent pas d’amélioration dépendante des anticorps (ADE) de la maladie. De plus, les anticorps scFv ne nécessitent pas non plus de systèmes d’expression de mammifères coûteux et peuvent être produits rapidement à grande échelle, ce qui les rend beaucoup moins chers à produire que les anticorps monoclonaux conventionnels.
Ces polypeptides simples non glycosylés sont de petites molécules simples très stables. Parmi l’ensemble d’anticorps, ceux qui ont montré une interaction avec la pointe S1 du SRAS-CoV-2, les protéines du domaine de liaison au récepteur (RBD) du delta du SRAS-CoV-2 et d’autres variants surveillés (VBM) ont été sélectionnés pour leur liaison, leur affinité et leur inhibition. . La plupart des mutations existantes ont été incluses dans les variantes préoccupantes actuellement connues.
Tous les variants de pointe et RBD ont été efficacement identifiés et liés à l’anticorps de bloc scFv76 (76clAbs), qui comprend les dérivés d’affinité matures de scFv76. L’affinité de scFv76 a dépassé celle des anticorps scFv5 et scFv86, ce qui est probablement dû aux épitopes différents de ces deux derniers anticorps. Les résultats de la résonance plasmonique de surface (SPR) ont également indiqué que les 76clAbs se lient aux mêmes épitopes ou à des épitopes très proches, tandis que le scFv5 se lie à un autre épitope.
Tous les 76clAbs reconnaissent la protéine SARS-CoV-2 native et empêchent sa liaison au récepteur de l’enzyme de conversion de l’angiotensine 2 (hACE2), mais pas aux autres anticorps scFv. À l’exception de scFv76-55, tous les 76clAb ont intériorisé la variable delta et d’autres mutations VBM sans perdre leur activité neutralisante.
Les concentrations inhibitrices ont diminué de 50 % (IC50) entre 0,36 et 4,30 nM (nM), contrairement aux concentrations supérieures à 40 nM, en dessous desquelles scFv5 et scFv86 ont permis l’élévation ou la liaison de RBD au récepteur.
Grâce à des expériences d’infection cellulaire, 76clAbs a supprimé l’infection de pseudovirus porteurs de pointe delta, de pointe D614G ou de protéines de pointe de plusieurs variantes préoccupantes (VOC) et VBM. Encore une fois, l’activité neutralisante la plus faible était avec scFv76-55, qui a montré la plus grande perte d’activité avec des mutations dans RBD.
Passant aux expériences avec les variantes virales d’origine, les scientifiques ont découvert que tous les 76clAb supprimaient également l’effet de la cytopathie (CPE) avec un titre de neutralisation précis de 50% (MN50) <15 nm par rapport à la variante delta.
Lorsqu’il a été ajouté 1 heure après l’inoculation de la culture cellulaire avec toutes les variantes du SRAS-CoV-2, y compris les souches ancestrales de Wuhan, D614G et Alpha, une inhibition efficace de toutes les variantes s’est produite. IC50 était inférieure à 22 nm.
Avec un prétraitement une heure avant l’inoculation du virus, la CI50 était inférieure à un dixième de celle-ci. Les mêmes résultats ont été observés en utilisant des sérums immuns regroupés de six donneurs COVID-19 convalescents, montrant un large écart entre la CI50 pour le prétraitement et le post-traitement des échantillons vaccinés.
Ces anticorps ont également perturbé la fusion transmembranaire induite par la pointe qui médie l’entrée virale dans les cellules hôtes. Ceci est considéré comme une caractéristique importante, car la formation de pneumocystis carinii semble être la lésion caractéristique de cette infection et est largement responsable de l’inflammation locale et de la thromboembolie. Cependant, à des concentrations nanomolaires, scFv76 a empêché la fusion avec les trois variantes ci-dessus.
Les 76clAbs étaient également associés à un épitope de type récepteur-liant (RBM) ; Cependant, scFv86, un anticorps non neutralisant, reconnaît un autre épitope avec des résidus critiques en dehors du RBM. La boucle de liaison 76clAb comprend les résidus F456, Y473, N487 et Y489, dont aucun n’est muté dans la variante Delta, aucune variante d’élévation VBM ou même la variante Omicron, bien que cette dernière souche SARS-CoV-2 ait le plus grand nombre de Mutation RBD. .
En effet, Omicron évite les anticorps neutralisants dans les sérums immuns et la plupart des anticorps monoclonaux anti-RBD. Cependant, tous les résidus sont restés intacts, indiquant la nature hautement conservée de cet épitope.
Ce groupe d’anticorps contient deux types dans les formes mono- et dimères de scFv76, les plus stables étant scFv76, scFv76-46 et scFv76-58. À 90 ° C, la structure en feuillet bêta plié de ces protéines se déplie. Ainsi, ces anticorps sont nébuliseurs sans perdre leur intégrité, leur nature protéolytique ou leur capacité à se lier à la protéine de pointe du SRAS-CoV-2.
L’administration intranasale de scFv76 à 37 μg/narine dans un modèle de souris transgénique a complètement supprimé l’infection virale lorsqu’elle était administrée deux heures avant ou quatre heures après l’infection. Les hamsters ont également été protégés contre la maladie clinique lorsque des doses similaires ont été administrées deux heures avant, puis une fois par jour pendant deux jours après l’infection.
D’autres tests ont montré que sous forme vaporisée, le scFv76 peut être efficacement délivré aux espaces alvéolaires, la quantité déposée s’accumulant avec le temps.
antiquités
Nous décrivons ici une classe d’anticorps humains anti-SARS-CoV-2 scFv avec une efficacité de neutralisation des sous-nanoparticules, une efficacité in vivo et une stabilité significative. Ces petits anticorps humains entiers sont des candidats prometteurs pour le traitement précoce du COVID-19 en tant qu’approche complémentaire à la vaccination actuelle et à l’immunisation systémique passive, qui n’induisent pas de défense muqueuse robuste.. «

/cloudfront-ap-southeast-2.images.arcpublishing.com/nzme/M5QEV4UDILDR56HMVIX4PU5EQM.jpg)