Décomposez et décomposez les protéines cancérigènes ! PROTACs, une nouvelle stratégie pour tuer les cellules cancéreuses
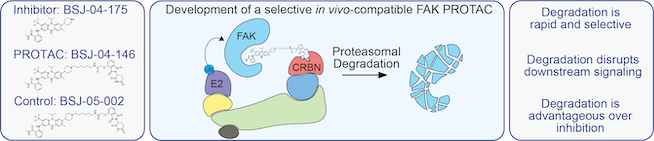
La dégradation ciblée des protéines, qui est une stratégie de destruction des protéines cancérigènes, est devenue ces dernières années l’un des domaines les plus importants de la découverte de médicaments. Les petites molécules connues sous le nom de PROteolysis-Targeting Chimeras (PROTACs) utilisent le propre mécanisme de nos cellules pour recycler les protéines, le système ubiquitine-protéasome (UPS), pour se débarrasser des protéines indésirables. Normalement, UPS modifie une protéine avec plusieurs copies d’une petite protéine régulatrice connue sous le nom d’ubiquitine. La protéine ubiquitinée est reconnue par l’UPS et dégradée. Les PROTAC sont une stratégie puissante pour rediriger l’UPS pour dégrader les protéines à volonté. Normalement, PROTAC se compose de deux ligands liés par un lieur : l’un recrute et se lie à la protéine cible, tandis que l’autre recrute et se lie à un complexe ubiquitine ligase, provoquant le marquage de la protéine cible avec l’ubiquitine. Une fois que la protéine cible a été étiquetée avec l’ubiquitine, UPS la décompose comme elle le ferait pour toute autre protéine ubiquitinée.
Cette approche est particulièrement attrayante dans le développement de médicaments pour cibler les protéines kinases qui stimulent la tumorigenèse grâce à leurs mécanismes catalytiques et d’échafaudage. Par exemple, la kinase d’adhésion focale (FAK) est une tyrosine kinase cytoplasmique non réceptrice dotée de fonctions d’échafaudage nucléaire qui joue un rôle important dans de nombreux processus cellulaires. Dans de nombreux types de cancer, y compris le cancer du pancréas et du sein, FAK est surexprimé, entraînant une augmentation de la prolifération, de la migration et de l’adhérence des cellules par le biais de mécanismes en aval. À ce jour, le domaine s’est largement concentré sur le développement de petites molécules inhibitrices de l’activité de la FAK kinase en tant qu’agents thérapeutiques contre le cancer. Dans un article récent sur chimiochimieLe Dr Behnam Nabat, professeur adjoint au Département de biologie humaine, et son équipe ont adopté une approche différente et ont développé un FAK PROTAC sélectif, appelé BSJ-04-146. « De nombreux inhibiteurs de FAK ont été développés, qui ont malheureusement montré une efficacité limitée dans les essais cliniques en tant que traitements contre le cancer », a déclaré le Dr Nabet. « Ces inhibiteurs ciblent les activités enzymatiques de FAK et ne perturbent pas ses fonctions non enzymatiques. » Contrairement aux inhibiteurs de kinase conventionnels, ProTax peut éliminer à la fois les fonctions catalytiques et d’échafaudage, offrant une nouvelle stratégie pour cibler les oncoprotéines. Le Dr Nabet vise à utiliser les PROTAC pour « perturber toutes les fonctions FAK nécessaires à l’amélioration des réponses anticancéreuses ».
Au début, Dr. Growing et son équipe ont lié l’inhibiteur de FAK VS-4718 avec une ubiquitine ligase et ont testé sa capacité à dégrader FAK dans des lignées cellulaires d’adénocarcinome pancréatique (PDAC). Bien que les PROTAC conjugués au VS-4718 aient dégradé le FAK, il a également montré des effets hors cible sur plusieurs kinases importantes. Par exemple, BSJ-03-136 a provoqué une dégradation significative de FAK et une phosphorylation réduite de AKT, qui est une cible en aval de FAK, ainsi qu’une déplétion de kinases telles que WEE1 et AURKA. Pour améliorer encore la sélectivité des FAK PROTAC, les auteurs ont réalisé une conception dirigée par la structure pour améliorer le profil de ciblage de la kinase du VS-4718 résultant en BSJ-04-175. Cet inhibiteur a montré une spécificité profonde envers FAK par rapport à VS-4718 et BSJ-03-136.
Pour comparer les réponses biologiques à l’inhibition de FAK avec la perte complète de FAK, les auteurs ont transformé BSJ-04-175 en un FAK PROTAC, appelé BSJ-04-146. La dégradation de FAK a été induite par BSJ-04-146 à des doses aussi faibles que 10 nM et a montré un effet fonctionnel significatif sur la signalisation FAK en aval. Les effets sont observés une heure après le traitement. Contrairement aux PROTAC conjugués au VS-4718, le BSJ-04-146 n’a pas provoqué de dégradation hors cible de la kinase et était remarquablement sélectif. De plus, les auteurs ont évalué les changements dans le phosphoprotéome après la dégradation de FAK par rapport à l’inhibition de FAK. La dégradation de FAK a entraîné des changements significatifs dans les phosphoprotéines, qui n’ont pas été observés lorsque FAK était inhibé. Ces observations sont cohérentes avec l’idée que FAK fonctionne à la fois comme une enzyme et un échafaudage protéique. En utilisant BSJ-04-146, les auteurs montrent que la dégradation de FAK a montré une diminution significative de la prolifération des cellules cancéreuses du pancréas et du sein se développant sous forme de sphéroïdes 3D ainsi que de la migration des cellules cancéreuses du sein, par rapport aux inhibiteurs de FAK. Enfin, BSJ-04-146 a été testé pour sa capacité à dégrader FAK dans des modèles murins. De manière passionnante, le Dr Nabet et son équipe ont confirmé que BSJ-04-146 montre une dégradation significative de FAK. in vivo. Montrez le travail du Dr. Napt a montré que « le ciblage de FAK pour la dégradation entraîne des réponses biologiques améliorées, par rapport à l’inhibition de l’activité de FAK ». Il a ajouté que la dégradation ciblée de FAK est « une stratégie utile qui nécessite un développement ultérieur en tant que nouvelle approche thérapeutique dans le cancer du pancréas ».


_1639115875543_1646277159692.jpg)

