Un nouveau modèle respiratoire prédit les mécanismes modifiés par les variants du SARS-CoV-2

Avec l’émergence de nouvelles variantes du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2), la pandémie de maladie à coronavirus 2019 (COVID-19) a été définie par des vagues d’infections et d’hospitalisations croissantes dans la population. Deux vagues notables ont été causées par les variantes SARS-CoV-2 Delta et Omicron.
Stady : La modélisation prédit les mécanismes altérés par les mutations des variants delta et omicron du SARS-CoV-2. Crédit d’image : D-Krab / Shutterstock.com
Dans le titre du virus de l’écouvillon nasal, la variante delta était associée à des charges trois fois plus élevées par rapport à la variante alpha, alors qu’une augmentation supplémentaire de 1,5 fois a été observée dans les écouvillons infectés par l’omicron. À ce jour, les modifications du site dans la pointe et d’autres domaines viraux ont été les seuls mécanismes proposés pour être responsables d’une telle escalade de l’infection nasale de l’hôte.
Dans une nouvelle étude publiée le bioRxiv * Serveur de préimpression, les chercheurs ont étudié trois voies potentielles d’infection cellulaire et de réplication virale qui ont été affectées par les mutations du SRAS-CoV-2 en utilisant un nouveau modèle respiratoire.
sur les études
Les chercheurs ont développé un modèle mécaniste, chez l’hôte, d’infection respiratoire pré-immune qui a été appliqué à des patients non immunisés, précédemment non infectés et immunodéprimés. Ce modèle a été utilisé pour prédire l’infection et la charge virale de l’exposition inhalée au SRAS-CoV-2 dans les voies respiratoires à court terme (heures à jours).
A ces échelles de temps, le modèle suppose que toutes les protections du système immunitaire ont disparu, ce qui correspond à une exposition à un nouveau virus. Tous les résultats utilisant ce modèle sont basés sur les meilleures données disponibles pour la variante SARS-CoV-2 Alpha.
Les chercheurs utilisent également le modèle pour étudier trois mécanismes potentiels des nombreuses mutations du SRAS-CoV-2 observées dans les variantes delta et omicron. L’infection cellulaire, ou le potentiel d’infection face à une cellule virion infectieuse par seconde, a été le premier mécanisme étudié à l’aide du modèle actuel.
La durée de la phase d’éclipse, ou le temps entre l’endocytose et la décharge du premier virion par une cellule nouvellement infectée, était le deuxième mécanisme, tandis que le troisième mécanisme était l’efficacité de la réplication virale, le nombre de virus infectieux se répliquant par jour.
Les auteurs ont cherché à identifier les changements dans les valeurs des paramètres les plus connus pour la variable alpha qui pourraient expliquer les fortes augmentations des variables delta et omicron dans les titres nasolabiaux.
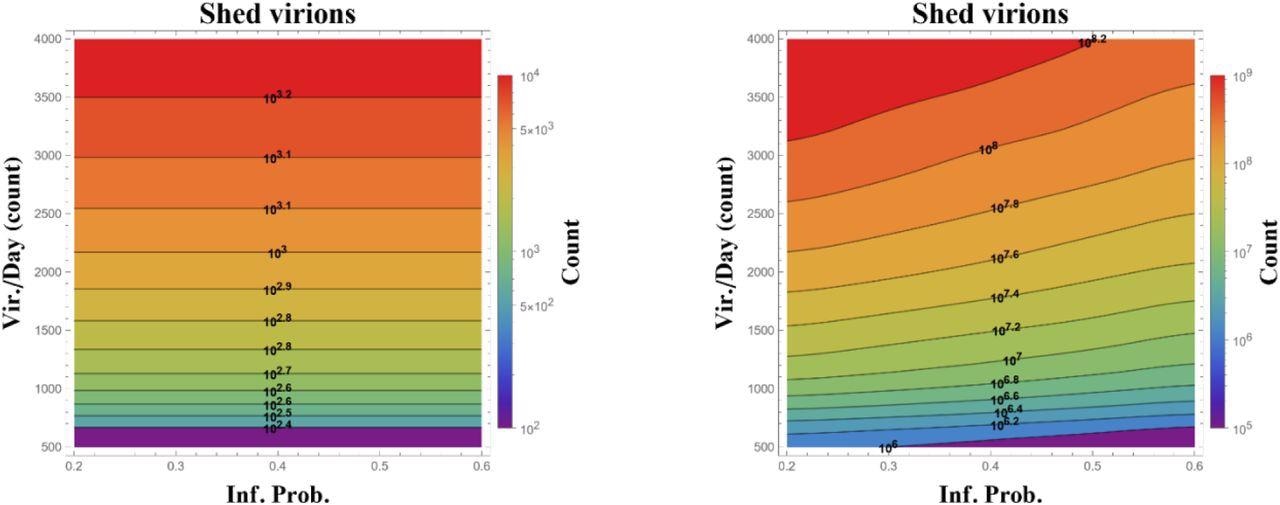
Diagramme de l’état total du virus infectieux répliqué sur 24 (à gauche) et 48 (à droite) à partir d’une seule cellule infectée (ciliée) dans le passage nasal supérieur, calculé sur les bandes de probabilité d’infection par rencontre de cellules ciliées par seconde (horizontalement) et le nombre de virus infectieux répéter quotidiennement (vertical). Les simulations commencent au début de l’infection cellulaire et supposent un temps de réponse variable alpha de 12 heures avant que les cellules infectées ne commencent à proliférer. Les données présentées sont des moyennes de plus de 100 réalisations, avec des ordres de grandeur par groupes de niveaux et dans la barre de couleur.
Résultats
Il n’y a eu ni un seul changement dans la probabilité d’infection ou le taux de récidive, ni une combinaison de mutations, qui se sont avérées responsables de l’augmentation de la charge virale des variantes delta et omicron par rapport à la variante alpha. Cependant, une explication plausible de cette charge virale accrue pourrait être due à l’efficacité accrue de la cellule infectée lors de la réplication, tandis que jusqu’à deux fois plus de filles infectées sont également éliminées par jour.
Les chercheurs ont ensuite réduit le temps de latence de leur expérience précédente, qui était de 12 heures, à deux heures, puis ont permis au modèle de fonctionner pendant deux jours consécutifs. A cet effet, une augmentation significative du nombre de cellules infectées sortant de la phase d’éclipse a été observée, ainsi qu’une augmentation de l’élimination des virus infectieux.
Plus précisément, la réduction de la période de latence de 12 à 6 heures a augmenté la charge virale de trois à quatre ordres de grandeur avec une moyenne de 500 à 4000 virions éliminés par jour après la latence.
Les observations faites dans la présente étude sont liées à des observations cliniques, où la variante delta a provoqué une augmentation des titres viraux jusqu’à trois ordres de grandeur. De plus, les chercheurs ont découvert que la combinaison du taux de réplication virale élevé et des temps de latence courts reflétait étroitement les charges virales d’Omicron.
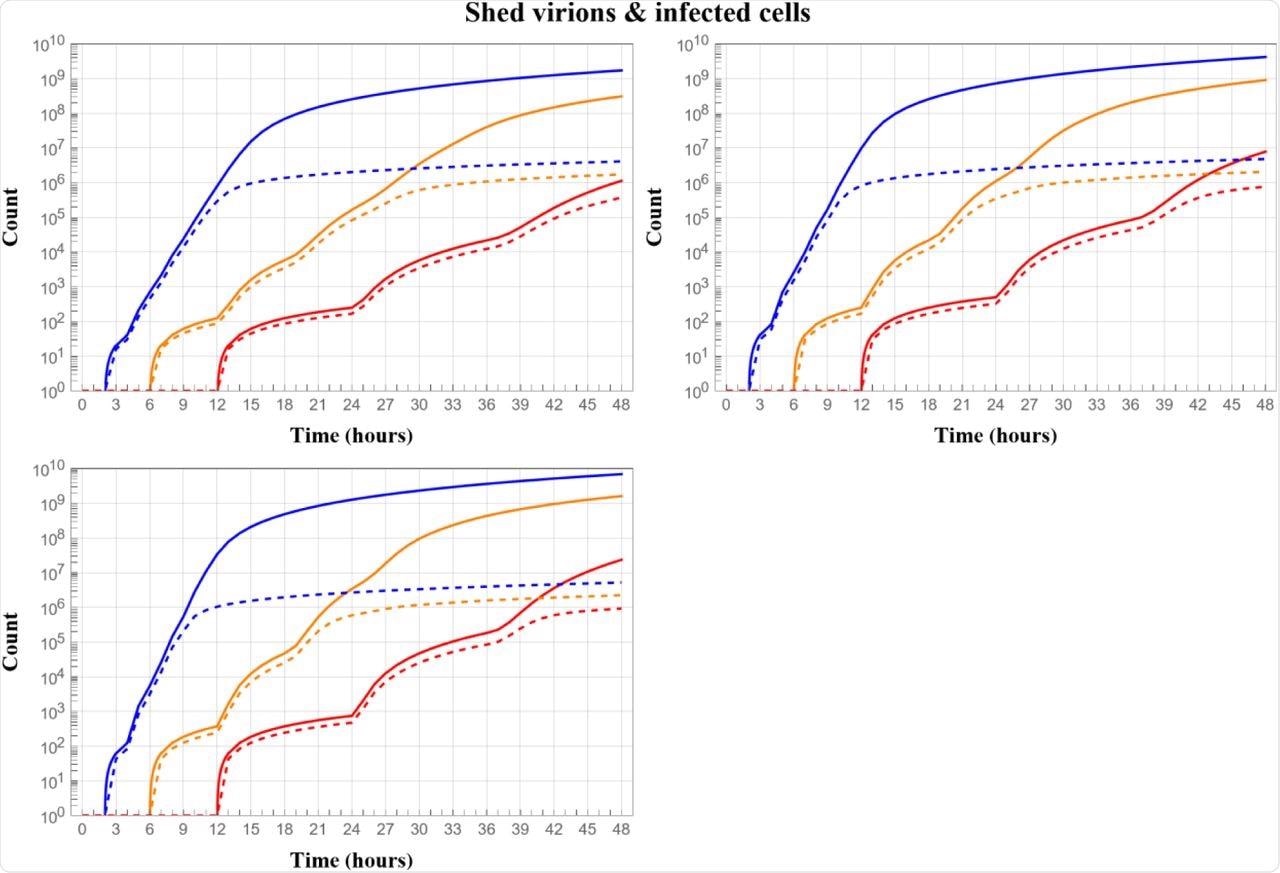
Évolution dynamique de la charge virale (courbes pleines) et du nombre total de cellules infectées (courbes en pointillés) sur 2 jours d’une seule cellule à partir du moment de l’infection, en comparant les résultats des phases d’éclipse de 12 (rouge), 6 (orange) et 2 (bleu) h, et pour l’élimination des cellules infectées le lendemain de la phase d’éclipse 500 (en haut à gauche), 1000 (en haut à droite), 1500 (en bas à gauche). Toutes les simulations de probabilité constante 0,2 de blessure par rencontre de cellule par seconde, telles qu’utilisées dans [Chen et al. 2022] pour la variable alpha.
conclusion
Les chercheurs se sont concentrés uniquement sur le passage nasal dans cette étude. Dans les 24 à 48 heures immédiatement après l’infection de l’une des cellules épithéliales nasales à l’entrée du passage nasal, le modèle éjecte la charge virale dans le passage nasal, s’écoule dans le nasopharynx et le nombre de cellules nasales infectées. Les chercheurs ont simulé les résultats de la charge virale et des cellules infectées pour ces trois effets mécaniques sur une gamme de paramètres cinétiques.
Le raccourcissement de la phase d’éclipse, le temps entre l’absorption cellulaire du virus et le début de la réplication et de l’excrétion du virus infectieux, pourrait à lui seul générer une charge virale trois à cinq fois plus élevée dans les deux jours suivant l’infection initiale, selon des simulations de modèles. L’augmentation des taux de réplication virale par une cellule infectée ne peut entraîner qu’une augmentation d’un ordre de la charge virale ; Cependant, l’augmentation de la sensibilité des cellules à l’infection n’a aucun effet et réduit la charge virale.
*Remarque importante
bioRxiv Il publie des rapports scientifiques préliminaires qui n’ont pas été évalués par des pairs et ne doivent donc pas être considérés comme concluants, guider la pratique clinique/les comportements liés à la santé, ou être traités comme des informations établies.
Référence de la revue :
- Pearson, ch. Whistler, T. Chen, A. et coll. (2022). La modélisation prédit les mécanismes altérés par les mutations des variants delta et omicron du SARS-CoV-2. bioRxiv. doi: 10.1101/ 2022.02.23.481492